必?fù)P醫(yī)藥(Beyang Therapeutics),成立于2021年,是一家既年輕又成熟的Biotech公司。基于ExCEED(Experiment + Computation w/ Enhanced Evaluation & DMPK)技術(shù)平臺(tái),必?fù)P專(zhuān)注于計(jì)算模擬技術(shù)和藥物發(fā)現(xiàn)實(shí)驗(yàn)技術(shù)的高度融合,尋找更快、更智能的方法來(lái)發(fā)現(xiàn)新的和更好的藥物。
基于多年在行業(yè)深耕的經(jīng)驗(yàn)和獨(dú)特的創(chuàng)新視角,胡齊悅在2021年創(chuàng)立了必?fù)P醫(yī)藥。他的初衷是:“我希望必?fù)P作為創(chuàng)新藥物的‘夢(mèng)工廠’,以另外一種方式,匯聚有各自專(zhuān)長(zhǎng)的人組成精煉小團(tuán)隊(duì),研發(fā)出Best in Class的分子,加速藥物研發(fā)進(jìn)程。”從分子設(shè)計(jì)、成藥性評(píng)價(jià)與生物學(xué)評(píng)價(jià)三個(gè)核心環(huán)節(jié)入手,必?fù)P期望打造一個(gè)能不斷產(chǎn)出高質(zhì)量分子的創(chuàng)新藥“夢(mèng)工廠”,助力中國(guó)創(chuàng)新藥走出國(guó)門(mén)、邁向海外。

01
計(jì)算機(jī)土壤上的
創(chuàng)新藥“夢(mèng)工廠”
全球高手組隊(duì)打造“夢(mèng)工廠”,專(zhuān)注創(chuàng)新藥
必?fù)P的團(tuán)隊(duì)來(lái)自世界各地,精煉且資深。
胡齊悅在Pfizer(輝瑞)La Jolla實(shí)驗(yàn)室工作十多年后,選擇回國(guó)加入恒瑞醫(yī)藥。在中國(guó)創(chuàng)新藥的發(fā)展萌芽階段,繼續(xù)深耕近十年后,成立了必?fù)P醫(yī)藥。公司創(chuàng)始團(tuán)隊(duì)成員均擁有超過(guò)20年新藥研發(fā)與計(jì)算模擬結(jié)合的實(shí)踐經(jīng)驗(yàn),累計(jì)對(duì)20余個(gè)臨床階段候選藥物或已上市新藥的研究與開(kāi)發(fā)做出過(guò)重要貢獻(xiàn),例如Adebrelimab、Axitinib、Crizotinib、Sunitinib、Sylatron等等。
必?fù)P的“夢(mèng)工廠”模式不僅在于小而精的團(tuán)隊(duì)本身,還在其強(qiáng)大的創(chuàng)造能力。
必?fù)P的優(yōu)勢(shì)體現(xiàn)在,具有挑戰(zhàn)性的靶點(diǎn)與適應(yīng)癥選擇,以及臨床前項(xiàng)目管線(xiàn)的推進(jìn)和有明顯差異化的數(shù)據(jù)。
成立不到三年,已經(jīng)有一款以滴眼治療眼底疾病的項(xiàng)目管線(xiàn)正在推進(jìn)臨床注冊(cè)申報(bào)研究,該適應(yīng)癥臨床可用藥物匱乏,且無(wú)治療指南推薦藥物,未滿(mǎn)足臨床需求巨大。同時(shí),另一款治療高危型白血病復(fù)發(fā)難治亞型的項(xiàng)目也即將進(jìn)入臨床注冊(cè)申報(bào)研究,該適應(yīng)癥標(biāo)準(zhǔn)療法為化療,尚無(wú)針對(duì)性靶向療法獲批,亦存在非常明確的未滿(mǎn)足臨床需求。

無(wú)論是眼科項(xiàng)目還是腫瘤項(xiàng)目,均在臨床前研究中,通過(guò)與所選適應(yīng)癥/靶點(diǎn)上最好的藥物頭對(duì)頭比較,充分證明其 Best in Class 潛力。
出生自帶計(jì)算機(jī)技術(shù)基因:CADD+AIDD
三年前,速石寫(xiě)過(guò)一篇文章,盤(pán)點(diǎn)了全球44家頂尖藥企用人工智能輔助新藥研發(fā)的現(xiàn)狀。到今天,依然可以得出這個(gè)結(jié)論:我們離主要靠計(jì)算機(jī)發(fā)現(xiàn)藥物,通過(guò)一大堆機(jī)器人完成實(shí)驗(yàn)測(cè)試,然后將它們送給患者的世界還相距甚遠(yuǎn)。
但這并不意味著,我們不能繼續(xù)往前。
正是計(jì)算機(jī)技術(shù)的應(yīng)用讓創(chuàng)新藥研發(fā)這件事情變得扁平化,把中國(guó)與世界的距離拉近。
必?fù)P從誕生的一刻起就自帶計(jì)算機(jī)技術(shù)基因 (CADD+AIDD)。
胡齊悅在輝瑞就專(zhuān)注于計(jì)算機(jī)輔助藥物研發(fā)的工作,在恒瑞任職期間,帶領(lǐng)團(tuán)隊(duì)充分發(fā)揮計(jì)算模擬與實(shí)驗(yàn)的協(xié)同作用,并將計(jì)算模擬的應(yīng)用從小分子領(lǐng)域進(jìn)一步拓展到包括抗體、重組蛋白、ADC和RNA等生物大分子形式。

胡齊悅表示,相比Me Too,做Best in Class會(huì)更需要計(jì)算機(jī)技術(shù)的幫助,或者說(shuō),借助這樣的技術(shù)可以把這件事做得更好。比如分子設(shè)計(jì),一般靠的是研究人員經(jīng)驗(yàn),他知道什么樣的化學(xué)結(jié)構(gòu)可以跟靶點(diǎn)有很好的結(jié)合。但一個(gè)人即使再有經(jīng)驗(yàn),也不可能窮舉所有可能性,這時(shí)候可以借助計(jì)算機(jī)的力量把已知可能的分子都設(shè)計(jì)出來(lái),通過(guò)一個(gè)評(píng)價(jià)體系來(lái)排序并選擇。
而一個(gè)奇思妙想的結(jié)構(gòu),有時(shí)能點(diǎn)燃創(chuàng)造的火花。
而像成藥性評(píng)價(jià),如果通過(guò)AI機(jī)器學(xué)習(xí)的算法模擬實(shí)驗(yàn)數(shù)據(jù)訓(xùn)練預(yù)測(cè)模型可以節(jié)省人力、物力以及實(shí)驗(yàn)資源,并能更快獲得最終的實(shí)驗(yàn)結(jié)果。
02
專(zhuān)注核心
借助外部的力量
Biotech的主業(yè),始終是前沿靶點(diǎn)和技術(shù),解決未滿(mǎn)足臨床需求。必?fù)P的“夢(mèng)工廠”模式,最重要的就是專(zhuān)注于自己的核心目標(biāo),同時(shí)充分借助外部的力量。
隨著整個(gè)制藥行業(yè)的發(fā)展與成熟,CRO、CMO、第三方研究所等專(zhuān)業(yè)機(jī)構(gòu)的出現(xiàn),為行業(yè)的發(fā)展帶來(lái)了全新的商業(yè)模式,很多非核心業(yè)務(wù)都可以被拆分出來(lái),實(shí)現(xiàn)“分布式”分工協(xié)同,讓必?fù)P的發(fā)展更輕松與高效。
比如,做新藥研發(fā)云平臺(tái)的速石科技就是必?fù)P的合作伙伴之一。
過(guò)去一年,必?fù)P在速石平臺(tái)的使用趨勢(shì)如下圖:

最高達(dá)到1500+核心并發(fā),最低值是0。
真正做到:需要的時(shí)候就在那。無(wú)需預(yù)測(cè),想用就用,用完即走。
給必?fù)P帶來(lái)的好處在于:
首先,輕松無(wú)負(fù)擔(dān)。無(wú)需增加自有資產(chǎn),占用公司現(xiàn)金流;
其次,使用方式靈活。需要的時(shí)候購(gòu)買(mǎi),用完即走,不需要培養(yǎng)一個(gè)專(zhuān)門(mén)的團(tuán)隊(duì);第三,減少前期摸索時(shí)間與降低試錯(cuò)成本。
還在美國(guó)工作的時(shí)候,胡齊悅就已經(jīng)知道云的優(yōu)勢(shì)了。
在恒瑞時(shí)他曾經(jīng)也想上云,但即便在大型藥企,從無(wú)到有地搭建一套可用研發(fā)環(huán)境依舊是復(fù)雜的:從爭(zhēng)取公司資源,到招聘專(zhuān)業(yè)人才,包括后續(xù)一系列采購(gòu)設(shè)備、設(shè)計(jì)底層架構(gòu)、打通網(wǎng)絡(luò)、部署系統(tǒng)、管理維護(hù)集群等工作。
考慮到這些繁瑣耗時(shí)的工作都需要他付出相當(dāng)大的精力,就一直沒(méi)往這個(gè)方向投入。
而在本地機(jī)器購(gòu)買(mǎi)完成的那一刻起,就開(kāi)始了固定資產(chǎn)的貶值。

創(chuàng)立了必?fù)P后,作為一家企業(yè)的創(chuàng)始人,面臨的問(wèn)題就更多更現(xiàn)實(shí)了。
專(zhuān)門(mén)準(zhǔn)備一個(gè)機(jī)房,招一堆人來(lái)搭建整個(gè)環(huán)境和底層架構(gòu),再專(zhuān)門(mén)找IT維護(hù)。他直接表示:“這個(gè)對(duì)于多數(shù)Biotech不實(shí)際”。而且每年可以投入到機(jī)房的費(fèi)用是一定的,但是需要做計(jì)算的事其實(shí)是在增長(zhǎng)的,這種模式也非常不靈活,很難匹配一家高速增長(zhǎng)的企業(yè)需求。
在胡齊悅看來(lái),速石提供的新藥研發(fā)云平臺(tái)是一條捷徑或者說(shuō)高速路,而這對(duì)藥物研發(fā)企業(yè)具有很重要的價(jià)值。

面對(duì)多樣的藥物研發(fā)場(chǎng)景和BIO/AI工具,如分子對(duì)接、虛擬篩選、蛋白質(zhì)折疊等,速石能為像必?fù)P這樣的用戶(hù)提供三大核心價(jià)值:
1. 標(biāo)準(zhǔn)藥物研發(fā)環(huán)境的規(guī)劃與搭建。
速石站在醫(yī)藥公司整個(gè)新藥研發(fā)體系與架構(gòu)視角進(jìn)行標(biāo)準(zhǔn)藥物研發(fā)環(huán)境的規(guī)劃與搭建,為企業(yè)提供一整套即開(kāi)即用的CADD/AIDD研發(fā)平臺(tái),一體化產(chǎn)品端到端交付到用戶(hù)手里。
有效降低用戶(hù)的前期投入與摸索成本,任何起步的公司都可以嘗試,沒(méi)有使用門(mén)檻,且對(duì)企業(yè)的未來(lái)擴(kuò)張有極強(qiáng)的兼容性與彈性。
2. 藥物設(shè)計(jì)研發(fā)流程的構(gòu)建與驗(yàn)證,BIO/AI應(yīng)用的適配和銜接。
速石深入藥物研發(fā)業(yè)務(wù)場(chǎng)景,為用戶(hù)提供藥物研發(fā)流程自動(dòng)化的構(gòu)建與驗(yàn)證,對(duì)上層BIO/AI應(yīng)用運(yùn)行提供支持與優(yōu)化,同時(shí)與底層資源聯(lián)動(dòng),給用戶(hù)更靈活、更高效使用資源的能力。
一方面把用戶(hù)原來(lái)手動(dòng)做的工作自動(dòng)化,大大提升用戶(hù)的工作效率;另一方面為用戶(hù)提供應(yīng)用與資源層面的最佳實(shí)踐參考,解決了研發(fā)場(chǎng)景里普遍存在的資源利用率不高、成本難以把控等問(wèn)題。
3. 處理研發(fā)與IT領(lǐng)域的交叉問(wèn)題。
做計(jì)算機(jī)輔助藥物研發(fā),遇到的通常是介于藥物研發(fā)與計(jì)算機(jī)IT領(lǐng)域的交叉問(wèn)題,定位困難,解決復(fù)雜,非常消耗用戶(hù)精力。速石能幫用戶(hù)預(yù)判部分問(wèn)題,通過(guò)自動(dòng)化減少部分問(wèn)題發(fā)生,定位并解決部分問(wèn)題,幫助用戶(hù)專(zhuān)注更重要的藥物研發(fā)工作。

此外,速石的新藥研發(fā)平臺(tái)還能支持市面上所有主流新藥研發(fā)應(yīng)用,和AlphaFold、RoseTTAFold等常用AI框架的快速搭建,并提供開(kāi)源/自有分子庫(kù)構(gòu)建與治理,如Zinc、Drugbank、Maybridge、Enamine等等。
速石常見(jiàn)BIO應(yīng)用實(shí)證:
Vina/ Amber/ MOE/ LeDock
03
思路拓展:
一個(gè)假設(shè)性問(wèn)題
我們問(wèn)了胡齊悅一個(gè)假設(shè)性的問(wèn)題:
“如果沒(méi)有預(yù)算,你會(huì)怎么使用我們平臺(tái)?”
或者換一種表達(dá)方式:“如果沒(méi)有資源限制,你會(huì)如何使用計(jì)算機(jī)技術(shù)來(lái)輔助藥物研發(fā)?”
他回答:“會(huì)用得更多。”
多跟少之間的權(quán)衡點(diǎn)具體有哪些?
第一, 研究的全面性。
面對(duì)資源限制,企業(yè)首要考慮的是該研究項(xiàng)目的必要性與重要性,然后計(jì)算需要投入的時(shí)間與資源量。這可能會(huì)嚴(yán)重影響研究的全面性。
以設(shè)計(jì)分子為例,藥物研發(fā)人員會(huì)從現(xiàn)有的資源與認(rèn)知出發(fā),制定研究計(jì)劃,無(wú)法考慮超出資源之外及認(rèn)知之外的可能性。
隨著研究邊界的不斷拓展,可能會(huì)因?yàn)橛邢薜馁Y源與認(rèn)知,對(duì)某一個(gè)項(xiàng)目帶來(lái)致命的、決定性的負(fù)面影響。而研發(fā)人員永遠(yuǎn)無(wú)法知道錯(cuò)過(guò)了什么。

第二,應(yīng)用與資源的適配。
資源限制會(huì)對(duì)研發(fā)人員使用應(yīng)用的方式提出要求,他們需要能根據(jù)任務(wù)特性挑選更合適、性?xún)r(jià)比更高的機(jī)器。
如果只選用大機(jī)型執(zhí)行任務(wù),將會(huì)浪費(fèi)大量資源,而如果錯(cuò)誤選擇了小機(jī)型,很可能中途會(huì)面臨任務(wù)失敗。
如何找到應(yīng)用與資源類(lèi)型、資源規(guī)模的最佳適配,需要不斷地學(xué)習(xí)和實(shí)踐。
第三,時(shí)間與金錢(qián)的取舍。
從事藥物研發(fā),研發(fā)速度不是唯一的考量。要提升研發(fā)的深度與廣度,實(shí)現(xiàn)整體效率的提升,充足的資源必不可少,但這也意味著企業(yè)需要付出更多的成本。企業(yè)需要在效率與成本間做抉擇,甚至需要根據(jù)外部環(huán)境的變化做動(dòng)態(tài)調(diào)整。這也是大部分企業(yè)都在面臨的難題。
Take Away
- 高手組團(tuán),小而精且靈活,計(jì)算機(jī)技術(shù)加持,專(zhuān)注有挑戰(zhàn)性的靶點(diǎn)與適應(yīng)癥,我們有理由期待必?fù)P醫(yī)藥將在創(chuàng)新藥研發(fā)這條路上越走越遠(yuǎn)。畢竟“夢(mèng)工廠”是為大家制造夢(mèng)想的地方,而生命/健康是人類(lèi)永恒的追求。
- 對(duì)計(jì)算機(jī)技術(shù)輔助藥物研發(fā)的信心,也就是CADD/AIDD到底能在創(chuàng)新藥研發(fā)過(guò)程中起到多大的作用,必?fù)P作為一家Biotech給國(guó)內(nèi)的醫(yī)藥公司們成功打了個(gè)樣。而我們提供給必?fù)P以及創(chuàng)新藥公司的價(jià)值,就是讓他們盡可能專(zhuān)注自己的研發(fā)業(yè)務(wù),其他事情都能交給我們。
- 生物制藥這個(gè)行業(yè),05、06年開(kāi)始一直往上走,到2015年達(dá)到頂峰,直到2021年開(kāi)始往下走了。但中國(guó)醫(yī)藥從“仿制藥”轉(zhuǎn)型“創(chuàng)新藥”這個(gè)大方向是不會(huì)變的,只是泡沫退去之后,不再有冒險(xiǎn)和神話(huà),只留下專(zhuān)業(yè)、理性和冷靜做事的人和公司。
關(guān)于必?fù)P
蘇州必?fù)P醫(yī)藥科技有限公司是一家創(chuàng)新的制藥公司,利用其專(zhuān)有的ExCEED 平臺(tái)來(lái)加速針對(duì)未滿(mǎn)足臨床需求的新藥發(fā)現(xiàn)和開(kāi)發(fā)進(jìn)程。創(chuàng)始人和管理團(tuán)隊(duì)平均擁有超過(guò)20年新藥研發(fā)經(jīng)驗(yàn),曾任職于輝瑞、默克、阿斯利康、先靈葆雅和恒瑞。他們?cè)谒幬锇悬c(diǎn)選擇、CADD、AIDD、生物篩選和優(yōu)化以及DMPK方面具有豐富的經(jīng)驗(yàn)。他們共同參與促成了20 多個(gè)臨床候選分子的開(kāi)發(fā),其中多個(gè)藥物(Adebrelimab、Axitinib、Crizotinib、Sunitinib、Sylatron等)已獲得 FDA 和 NMPA 的批準(zhǔn),于中美兩地上市。
必?fù)P建立了專(zhuān)有的計(jì)算機(jī)加速藥物發(fā)現(xiàn)整合平臺(tái)ExCEED,該平臺(tái)利用新的分子生成和優(yōu)化方法 MMPT 和計(jì)算機(jī) DMPK 模擬預(yù)測(cè)來(lái)指導(dǎo)臨床前候選分子的發(fā)現(xiàn)和開(kāi)發(fā),能夠大幅拓展可探索化學(xué)空間,打破制藥專(zhuān)家固有思維的桎梏,從而提高藥物研發(fā)效率,獲得更優(yōu)質(zhì)的分子。公司專(zhuān)注于眼科、腫瘤等具備臨床未滿(mǎn)足需求的疾病領(lǐng)域,旨在打造全球新藥研發(fā)界的“DreamWorks”(夢(mèng)工廠),充分發(fā)揮團(tuán)隊(duì)在藥物發(fā)現(xiàn)階段的優(yōu)勢(shì),自建管線(xiàn)與合作授權(quán)開(kāi)發(fā)(License-out or Co-development) 并行。
關(guān)于fastone云平臺(tái)在各種BIO應(yīng)用上的表現(xiàn),可以點(diǎn)擊以下應(yīng)用名稱(chēng)查看:
速石科技新藥研發(fā)行業(yè)白皮書(shū),可以戳下方查看:
新藥研發(fā)37問(wèn) │ 頂尖藥企AIDD調(diào)研
-END-
我們有個(gè)一站式新藥研發(fā)平臺(tái)
集成行業(yè)應(yīng)用與自編譯軟件
支持AlphaFold、RoseTTAFold等常用AI應(yīng)用
可視化Workflow隨心創(chuàng)建、便捷分享
提供Zinc、Drugbank等開(kāi)源/自有分子庫(kù)
CADD專(zhuān)家團(tuán)隊(duì)全面支持
掃碼免費(fèi)試用,送200元體驗(yàn)金,入股不虧~
P封面-1024x517.png)
更多BIO電子書(shū)歡
迎掃碼關(guān)注小F(ID:iamfastone)獲取

你也許想了解具體的落地場(chǎng)景:
王者帶飛LeDock!開(kāi)箱即用&一鍵定位分子庫(kù)+全流程自動(dòng)化3.5小時(shí)完成20萬(wàn)分子對(duì)接
1分鐘告訴你用MOE模擬200000個(gè)分子要花多少錢(qián)
155個(gè)GPU!多云場(chǎng)景下的 Amber自由能計(jì)算
提速2920倍!用AutoDock Vina對(duì)接2800萬(wàn)個(gè)分子
新藥研發(fā)平臺(tái):
國(guó)產(chǎn)調(diào)度器之光——Fsched到底有多能打?
創(chuàng)新藥研發(fā)九死一生,CADD/AIDD是答案嗎?
全球44家頂尖藥企AI輔助藥研行動(dòng)白皮書(shū)
近期重大事件:
速石科技入駐粵港澳大灣區(qū)算力調(diào)度平臺(tái),參與建設(shè)數(shù)算用一體化發(fā)展新范式
速石科技成NEXT PARK產(chǎn)業(yè)合伙人,共同打造全球領(lǐng)先的新興產(chǎn)業(yè)集群
速石科技出席ICCAD2023,新一代芯片研發(fā)平臺(tái)助力半導(dǎo)體企業(yè)縮短研發(fā)周期
速石科技與芯啟源開(kāi)啟戰(zhàn)略合作,聯(lián)手打造軟硬件一體芯片研發(fā)云平臺(tái)
速石科技作為特邀服務(wù)商入駐IC PARK,合力打造集成電路產(chǎn)業(yè)新生態(tài)
速石科技成為國(guó)家“芯火”深圳雙創(chuàng)基地(平臺(tái))戰(zhàn)略合作伙伴,推動(dòng)國(guó)產(chǎn)EDA公共技術(shù)服務(wù)云平臺(tái)建設(shè)


本篇來(lái)說(shuō)下CADD對(duì)藥物設(shè)計(jì)領(lǐng)域產(chǎn)生了重大影響。此外,CADD與人工智能(AI)、機(jī)器學(xué)習(xí)(ML)和深度學(xué)習(xí)(DL)技術(shù)相結(jié)合,處理大量生物數(shù)據(jù),減少了與藥物開(kāi)發(fā)過(guò)程相關(guān)的時(shí)間和成本。
1.概述
計(jì)算機(jī)輔助藥物設(shè)計(jì)(CADD)結(jié)合了各種計(jì)算機(jī)工具,以識(shí)別和開(kāi)發(fā)有前途的lead。CADD包括計(jì)算化學(xué)、分子建模、分子設(shè)計(jì)和合理的藥物設(shè)計(jì)。在當(dāng)今的大數(shù)據(jù)環(huán)境中,訪問(wèn)大量數(shù)據(jù)并不能保證獲得適用的預(yù)測(cè)模型。為了預(yù)測(cè)治療效果和副作用,必須開(kāi)發(fā)系統(tǒng)地解決大量、多維和稀疏數(shù)據(jù)源的技術(shù)。
1.1 計(jì)算機(jī)輔助藥物設(shè)計(jì)
CADD基于蛋白質(zhì)或配體的3D結(jié)構(gòu)的可用性,利用兩種不同的技術(shù)進(jìn)行藥物發(fā)現(xiàn):基于結(jié)構(gòu)的藥物設(shè)計(jì)(SBDD)和基于配體的藥物設(shè)計(jì)(LBDD)(圖1)。在某些情況下,兩種技術(shù)的整合在查找先導(dǎo)分子方面顯示出良好的準(zhǔn)確性。
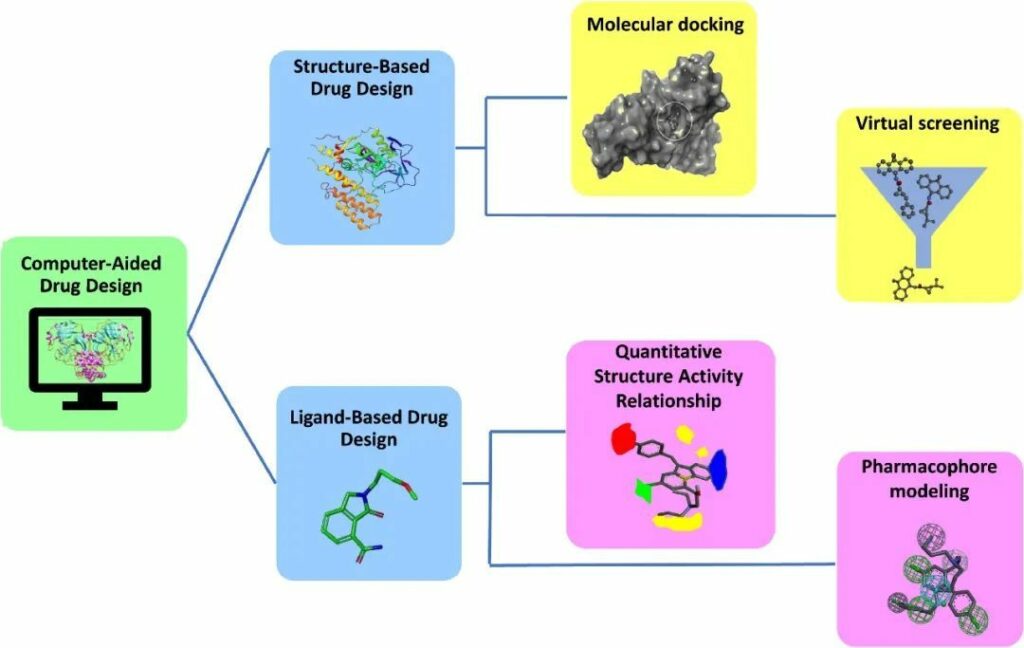
圖1 -CADD概覽
1.1.1 SBDD
基于結(jié)構(gòu)的藥物設(shè)計(jì)(SBDD):隨著越來(lái)越多生物分子的三維結(jié)構(gòu)的公開(kāi),SBDD在藥物發(fā)現(xiàn)和設(shè)計(jì)方面的新時(shí)代已經(jīng)開(kāi)始。SBDD已成為制藥行業(yè)中生成和優(yōu)化配體的可能手段。靶標(biāo)的識(shí)別、結(jié)合位點(diǎn)的鑒定、分子對(duì)接、虛擬篩選和分子動(dòng)力學(xué)是SBDD的基本步驟。
1.1.1.1靶標(biāo)準(zhǔn)備
準(zhǔn)備靶點(diǎn)大分子結(jié)構(gòu)是SBDD中最關(guān)鍵的一步。由于X射線(xiàn)和NMR結(jié)構(gòu)解析技術(shù)的快速發(fā)展,沉積在蛋白質(zhì)數(shù)據(jù)庫(kù)(PDB)中的蛋白質(zhì)的3D結(jié)構(gòu)很容易獲得。當(dāng)目標(biāo)蛋白的三維結(jié)構(gòu)不可用時(shí),計(jì)算方法,如比較或同源建模(comparative or homology modeling)、threading和ab initio已經(jīng)能成功地從蛋白質(zhì)的序列中確定其結(jié)構(gòu)。
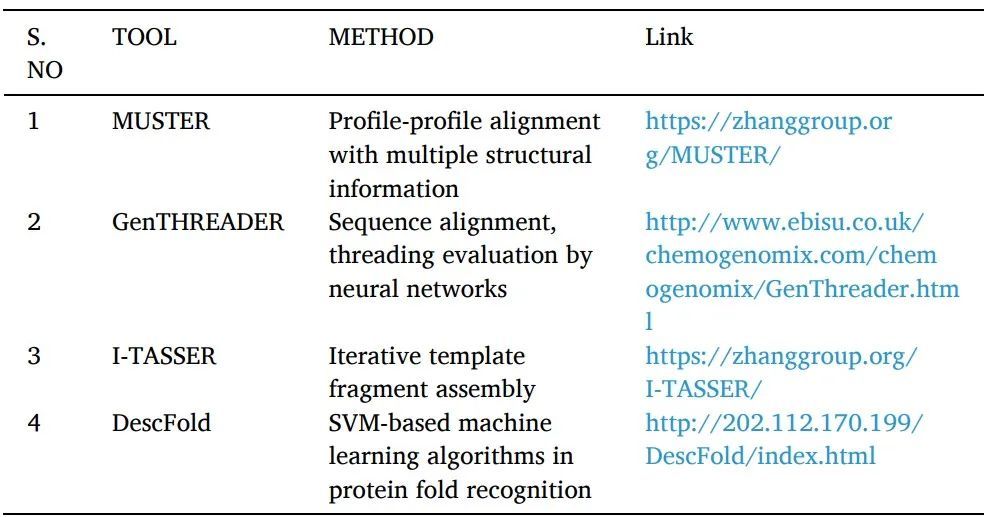
同源建模或比較建模:可以使用各種計(jì)算結(jié)構(gòu)預(yù)測(cè)技術(shù)(包括同源性建模)從其氨基酸序列推斷蛋白質(zhì)3D結(jié)構(gòu)(表1)。它被認(rèn)為是精度最高的計(jì)算結(jié)構(gòu)預(yù)測(cè)方法。其中有幾個(gè)簡(jiǎn)單且易于遵循的步驟:尋找具有相似序列的結(jié)構(gòu)模板蛋白,對(duì)齊它們的序列,使用對(duì)齊的區(qū)域坐標(biāo),預(yù)測(cè)目標(biāo)缺失的原子坐標(biāo),模型構(gòu)建和細(xì)化。NCBI基本局部比對(duì)搜索工具(BLAST)是用于序列相似性搜索的最廣泛使用的生物信息學(xué)序列比對(duì)工具之一。

Fold recognition or threading:用于尋找具有可比折疊但沒(méi)有序列相似性的蛋白質(zhì)。一個(gè)已知的蛋白質(zhì)結(jié)構(gòu)的序列被感興趣的目標(biāo)的查詢(xún)序列所取代,對(duì)于該結(jié)構(gòu)是未知的。然后用各種評(píng)分系統(tǒng)對(duì)產(chǎn)生的"threaded"結(jié)構(gòu)進(jìn)行評(píng)估。對(duì)每個(gè)數(shù)據(jù)庫(kù)的經(jīng)驗(yàn)確定的三維結(jié)構(gòu)重復(fù)這一過(guò)程,提供與查詢(xún)序列最匹配的結(jié)構(gòu)(表2)。它被運(yùn)用于SBDD研究中。
表2 threading方法工具
從頭或從頭建模:當(dāng)結(jié)構(gòu)中沒(méi)有足夠的同質(zhì)性來(lái)進(jìn)行比較建模時(shí),將執(zhí)行從頭或從頭建模(表3)。
表3 用于從頭建模的工具

1.1.1.2活性結(jié)合位點(diǎn)的鑒定和表征
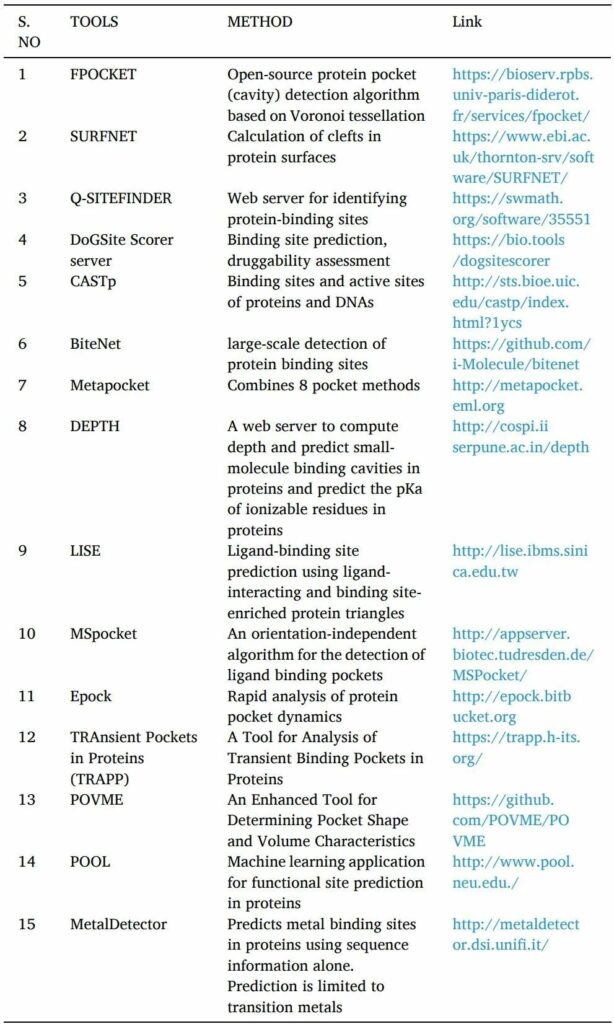
藥物活性需要蛋白質(zhì)和配體的相互作用。只有找到高親和力結(jié)合位點(diǎn)才有可能。在基于結(jié)構(gòu)的藥物發(fā)現(xiàn)方法中開(kāi)發(fā)新方法在很大程度上取決于識(shí)別靶蛋白上的可藥腔或口袋。
POCKET,SURFNET,Q-SITE FINDER,DoGSite Scorer server,CASTp,NSiteMatch,metapocket等工具是用于預(yù)測(cè)靶點(diǎn)蛋白結(jié)合位點(diǎn)的計(jì)算機(jī)工具。
找到結(jié)合位點(diǎn)后,使用諸如Epock,TRAPP和POVME等工具或服務(wù)器來(lái)確定結(jié)合口袋的體積(表4)。
1.1.1.3 分子對(duì)接
表4 結(jié)合位點(diǎn)預(yù)測(cè)工具
分子對(duì)接是一種用于確定配體分子在大分子靶標(biāo)結(jié)合位點(diǎn)中的構(gòu)象和取向(統(tǒng)稱(chēng)為“位置”)的技術(shù)。
搜索算法用于生成姿勢(shì),然后使用評(píng)分技術(shù)進(jìn)行排名。許多生物過(guò)程,如信號(hào)傳遞、細(xì)胞控制和其他大分子組裝,依賴(lài)于分子識(shí)別,如酶-底物、藥物-蛋白質(zhì)、藥物-核酸、蛋白質(zhì)-核酸和蛋白質(zhì)-蛋白質(zhì)相互作用。采樣和評(píng)分是蛋白質(zhì)-配體對(duì)接方法的兩個(gè)關(guān)鍵組成部分。
配體采樣和蛋白質(zhì)靈活性是采樣的兩個(gè)方面,指的是在蛋白質(zhì)結(jié)合位點(diǎn)附近創(chuàng)建可能的配體結(jié)合方向/構(gòu)象。評(píng)分使用物理方法或經(jīng)驗(yàn)預(yù)測(cè)單個(gè)配體取向/構(gòu)象的結(jié)合緊密性。
表5 對(duì)接工具/軟件的清單

蛋白質(zhì)-配體對(duì)接的分類(lèi)方法有幾種。
根據(jù)蛋白質(zhì)靈活性,方法分為四類(lèi):
軟對(duì)接:在對(duì)接模擬中,它放松了原子間Vander Waals接觸,允許配體和蛋白質(zhì)之間略有重疊。
側(cè)鏈靈活性:早期的研究之一是Leach的配體對(duì)接方法,該方法使用旋轉(zhuǎn)體庫(kù)來(lái)結(jié)合離散的側(cè)鏈靈活性。從那時(shí)起,已經(jīng)提出了一系列新技術(shù),用于在配體對(duì)接中添加連續(xù)或離散的側(cè)鏈靈活性。
分子弛豫:第三種方法考慮蛋白質(zhì)的柔韌性,通過(guò)使用剛體對(duì)接將配體引入結(jié)合位點(diǎn),然后松弛蛋白質(zhì)主鏈和附近的側(cè)鏈原子。初始剛體對(duì)接允許蛋白質(zhì)和插入的配體取向/構(gòu)象之間的原子沖突,以適應(yīng)蛋白質(zhì)構(gòu)象差異。使用蒙特卡羅(MC)模擬,分子動(dòng)力學(xué)模擬或其他方法松弛或最小化復(fù)合物。
蛋白質(zhì)集合對(duì)接:添加蛋白質(zhì)柔韌性的最廣泛使用的方法涉及蛋白質(zhì)結(jié)構(gòu)的集合,以反映各種構(gòu)象變化。
根據(jù)配體采樣,方法分為兩類(lèi):
有兩種配體采樣算法:系統(tǒng)搜索和隨機(jī)算法(表6)。
表6使用隨機(jī)或系統(tǒng)搜索算法的軟件/工具
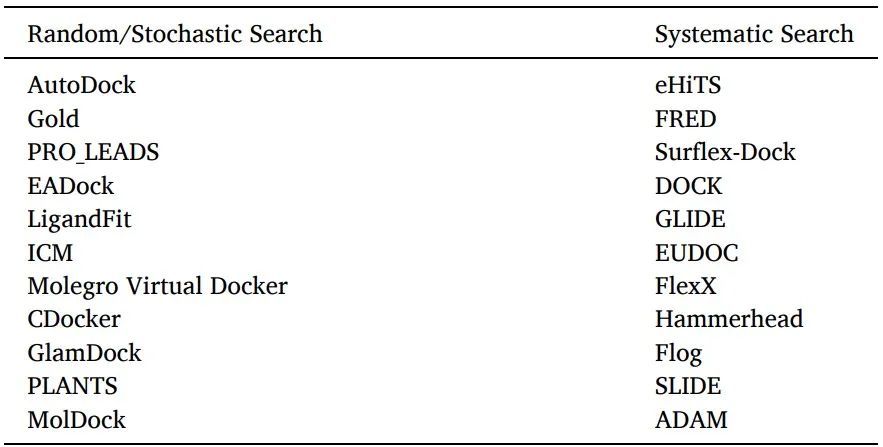
系統(tǒng)搜索:對(duì)于靈活的配體對(duì)接,通常使用系統(tǒng)搜索技術(shù),通過(guò)探索配體的所有自由度來(lái)創(chuàng)建所有潛在的配體結(jié)合構(gòu)象。
隨機(jī)算法:通過(guò)在構(gòu)象空間和配體的平移/旋轉(zhuǎn)空間的每一步對(duì)配體進(jìn)行隨機(jī)修改,在隨機(jī)算法中對(duì)配體結(jié)合取向和構(gòu)象進(jìn)行采樣。
根據(jù)評(píng)分功能,方法分為三類(lèi):
對(duì)接分?jǐn)?shù)是基于評(píng)估復(fù)合體能量親和力的評(píng)分函數(shù)的計(jì)算。這些評(píng)分函數(shù)可以在分子力學(xué)、經(jīng)驗(yàn)數(shù)據(jù)、專(zhuān)業(yè)知識(shí)或共識(shí)庫(kù)上找到。共識(shí)評(píng)分(Consensus scoring)是一種通過(guò)組合幾種評(píng)分算法的結(jié)果來(lái)預(yù)測(cè)化合物對(duì)特定靶標(biāo)的結(jié)合親和力的方法。根據(jù)推導(dǎo)方法分為三個(gè)基本類(lèi)別:基于力場(chǎng)、基于經(jīng)驗(yàn)和基于知識(shí)的評(píng)分函數(shù)。
力場(chǎng)(FF)評(píng)分函數(shù):基于配體結(jié)合能分解為單個(gè)相互作用項(xiàng),例如范德華(VDW)能量,靜電能,鍵拉伸/彎曲/扭轉(zhuǎn)能等,使用一組派生的力場(chǎng)參數(shù),例如AMBER或CHARMM力場(chǎng)。
經(jīng)驗(yàn)評(píng)分函數(shù):配合物的結(jié)合能得分是通過(guò)將幾個(gè)加權(quán)經(jīng)驗(yàn)?zāi)茼?xiàng)(如VDW能,靜電能,氫鍵能,脫溶劑化項(xiàng),熵項(xiàng),疏水性項(xiàng)等)相加得出。
基于知識(shí)的評(píng)分函數(shù):直接從實(shí)驗(yàn)確定的蛋白質(zhì)配體復(fù)合物中的結(jié)構(gòu)信息生成平均力的電位,由玻爾茲曼反比關(guān)系描述為基于知識(shí)的評(píng)分函數(shù)提供基礎(chǔ)。
1.1.1.4 虛擬篩選(VS)
在計(jì)算機(jī)中,從化學(xué)數(shù)據(jù)庫(kù)中選擇有希望的化合物的方法被稱(chēng)為虛擬篩選,并且可以被認(rèn)為是實(shí)驗(yàn)生物學(xué)評(píng)估方法的計(jì)算機(jī)化等效物,如高通量篩選(HTS)。
VS分為兩類(lèi):(i)基于結(jié)構(gòu)的虛擬篩選(SBVS)和(ii)基于配體的虛擬篩選(LBVS)(圖2)。

圖2 基于結(jié)構(gòu)和基于配體的虛擬篩選概述
基于結(jié)構(gòu)的虛擬篩選(SBVS):這是一種基于計(jì)算機(jī)的方法,用于在早期藥物開(kāi)發(fā)項(xiàng)目中針對(duì)特定治療靶點(diǎn)搜索化合物庫(kù)中的新型生物活性化合物。SBVS中的化合物數(shù)據(jù)庫(kù)停靠在預(yù)定的靶標(biāo)結(jié)合位點(diǎn)。除了預(yù)測(cè)結(jié)合模式外,SBVS還為對(duì)接的分子分配排名。該評(píng)級(jí)可以用作選擇有前途的分子的唯一標(biāo)準(zhǔn),也可以與其他評(píng)估方法結(jié)合使用。進(jìn)行實(shí)驗(yàn)以確定所研究分子靶標(biāo)上指示藥物的生物活性。SBVS包括四個(gè)步驟:(i)分子靶標(biāo)準(zhǔn)備(ii)化合物數(shù)據(jù)庫(kù)選擇(iii)分子對(duì)接和(iv)對(duì)接后分析。
表7 用于以圖形方式顯示SBVS和分子對(duì)接結(jié)果的程序

基于配體的虛擬篩選(LBVS):通過(guò)采用稱(chēng)為基于配體的虛擬篩選的計(jì)算技術(shù),可以根據(jù)有效結(jié)合到靶標(biāo)的配體的信息生成靶蛋白的模型。之后,使用該模型預(yù)測(cè)新配體與靶標(biāo)結(jié)合的可能性。LBVS是唯一沒(méi)有靶蛋白3D結(jié)構(gòu)的方法。LBVS試圖使用已知的活性化學(xué)物質(zhì)作為輸入信息來(lái)識(shí)別具有相似屬性的結(jié)構(gòu)多樣化的分子。
1.1.1.5 分子動(dòng)力學(xué)(MD)模擬
這種復(fù)雜的物理技術(shù)基于牛頓引導(dǎo)原子間相互作用的運(yùn)動(dòng)方程。它用于預(yù)測(cè)分子系統(tǒng)中每個(gè)原子相對(duì)于時(shí)間的位置。分子動(dòng)力學(xué)(MD)模擬對(duì)于研究蛋白質(zhì)行為至關(guān)重要。在MD模擬中,化學(xué)鍵和鍵角使用簡(jiǎn)單的虛擬彈簧描繪,而二面角則使用正弦函數(shù)處理。GPU 最初設(shè)計(jì)用于加速視頻游戲,現(xiàn)在正用于顯著加速分子動(dòng)力學(xué)模擬。分子力學(xué)泊松-玻爾茲曼表面積(MM / PBSA),線(xiàn)性相互作用能(LIE)(和自由能擾動(dòng)方法(FEP)是用于自由能計(jì)算的一些MD應(yīng)用,以關(guān)聯(lián)實(shí)驗(yàn)和計(jì)算的小分子與蛋白質(zhì)的結(jié)合親和力。分子動(dòng)力學(xué)模擬可以使用牛頓物理學(xué)和力場(chǎng)(如Amber或CHARMM OPLS,GROMOS和粗粒度力場(chǎng)(表8)計(jì)算構(gòu)象軌跡作為時(shí)間的函數(shù)。
表8 MD仿真中使用的力場(chǎng)列表

AMBER(具有能量細(xì)化的輔助模型構(gòu)建):AMBER是一組分子模擬程序和一組用于模擬生物分子的分子機(jī)械力場(chǎng)。Peter Kollman的小組在1970年代后期在加州大學(xué)舊金山分校開(kāi)發(fā)了這種方法,以研究各種分子,如蛋白質(zhì),DNA,RNA,碳水化合物,有機(jī)分子,蛋白質(zhì)模擬物,脂質(zhì)和氟化芳香族氨基酸。為了施加分子對(duì)稱(chēng)性,在全原子原子輔助模型構(gòu)建與能量細(xì)化(AMBER)系列力場(chǎng)中,部分電荷被分配具有靜電表面電位。
CHARMM(哈佛大學(xué)大分子力學(xué)化學(xué)):CHARMM程序最初由哈佛大學(xué)的Martin Karplus教授小組開(kāi)發(fā),該小組協(xié)調(diào)經(jīng)驗(yàn)力場(chǎng)參數(shù)化的努力。它具有針對(duì)各種分子參數(shù)化的特定力場(chǎng)。CHARMM力場(chǎng)中的部分電荷通常適合從頭計(jì)算的尺度能量。
OPLS(液體模擬的優(yōu)化電位):與實(shí)驗(yàn)結(jié)果相比,OPLS力場(chǎng)在預(yù)測(cè)蒙特卡羅模擬獲得的結(jié)構(gòu)和熱力學(xué)特性方面表現(xiàn)出準(zhǔn)確性。
OPLS-AA力場(chǎng),用于重現(xiàn)小分子的量子力學(xué)構(gòu)象能量分布。此外,它還從AMBER中獲得了幾個(gè)粘結(jié)參數(shù)。
GROMOS(格羅寧根分子模擬):GROMOS是一種用于研究生物分子系統(tǒng)的分子動(dòng)力學(xué)的多用途計(jì)算機(jī)模擬工具。它還具有內(nèi)置力場(chǎng),包括蛋白質(zhì)、核苷酸、糖和其他分子。它可用于模擬各種化學(xué)和物理系統(tǒng),包括玻璃、液晶、聚合物、晶體和生物分子溶液。
粗粒度力場(chǎng)(CG):CG力場(chǎng)通過(guò)減少模型中的自由度數(shù)來(lái)降低計(jì)算的計(jì)算成本,從而允許對(duì)更大的系統(tǒng)進(jìn)行更長(zhǎng)時(shí)間的仿真。粗粒度(CG)模型有兩種常規(guī)方法:自下而上和自上而下。許多化合物的極性相和非極性相之間的自由能分配是CGMartini力場(chǎng)的基礎(chǔ)。Martini力場(chǎng)也是與原子模型密切合作開(kāi)發(fā)的,特別是在束縛相互作用方面。
1.1.2 LBDD
在沒(méi)有關(guān)于受體的3D信息的情況下,可使用基于配體的藥物設(shè)計(jì)。該技術(shù)依賴(lài)于與感興趣的生物靶標(biāo)結(jié)合的分子知識(shí)。
與靶標(biāo)結(jié)合的已知配體的化學(xué)指紋圖譜用于分子相似性方法,以使用分子庫(kù)進(jìn)行篩選來(lái)鑒定具有相似指紋的化合物(表9)。配體相似性搜索方法是有效的,因?yàn)榻Y(jié)構(gòu)相關(guān)的化合物具有相當(dāng)?shù)慕Y(jié)合特性。
表9 小分子數(shù)據(jù)庫(kù)

QSAR和藥效團(tuán)是LBDD的兩種方法。
1.1.2.1 QSAR
QSAR是一種計(jì)算機(jī)化的統(tǒng)計(jì)工具,用于解釋觀察到的由替換產(chǎn)生的結(jié)構(gòu)變化(表10)。這些模型用數(shù)學(xué)方法證明配體的結(jié)構(gòu)特性如何影響與之結(jié)合的靶點(diǎn)的活性反應(yīng)。可用于建立QSAR模型的分子參數(shù)可能包括電子、疏水、立體和亞結(jié)構(gòu)效應(yīng)。
QSAR的工具如下。
表10 QSAR工具
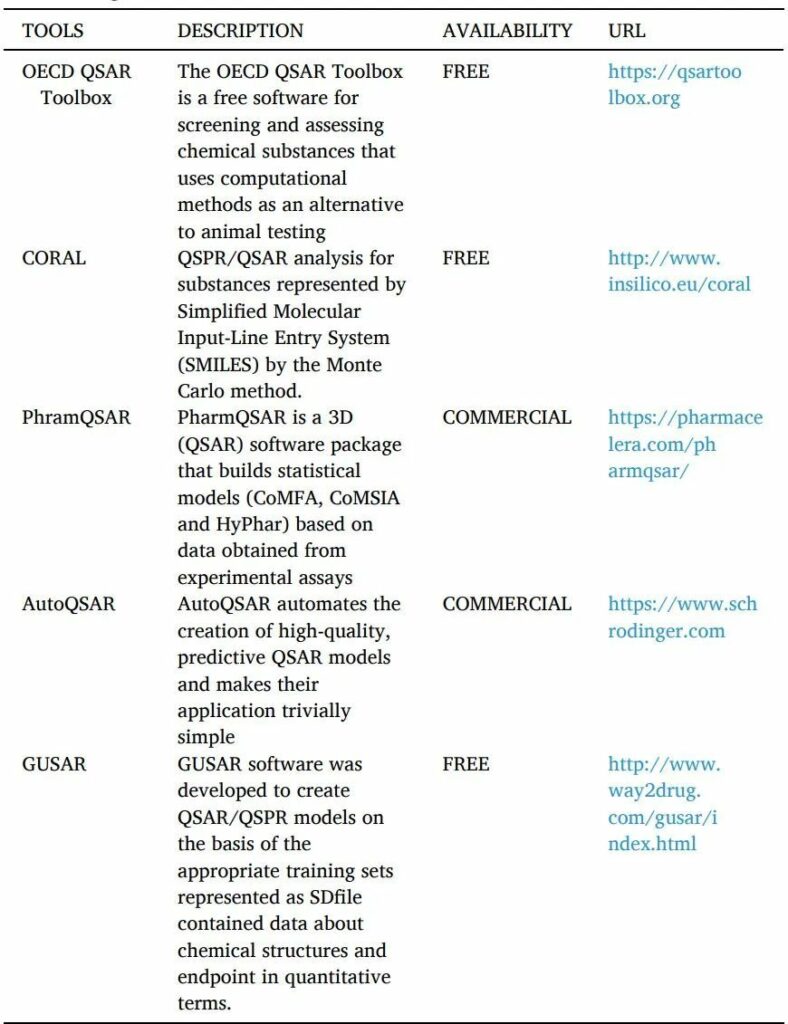
詳細(xì)參數(shù):
電子效果:電離常數(shù)、Σ取代基常數(shù)、分布常數(shù)、共振效應(yīng)、場(chǎng)效應(yīng)、分子軌道指數(shù)、原子/電子凈電荷、親核超離域性、親電超離域性、自由基超離域性、最低空分子軌道和最高占據(jù)分子軌道的能量、前沿原子-原子極化率、分子間庫(kù)侖相互作用能、由一組電荷在點(diǎn)(A)處產(chǎn)生的電場(chǎng)分子。
疏水參數(shù):分配系數(shù)、Pi取代基常數(shù)、液-液色譜中的Rm值、高壓液相色譜(HPLC)中的洗脫時(shí)間、溶解度、溶劑分配系數(shù)。
空間效應(yīng):分子內(nèi)空間位阻效應(yīng)、空間位阻取代基常數(shù)、超共軛校正、摩爾體積、摩爾折射率、MR 取代基常數(shù)、分子量、范德華半徑原子間距離。
子結(jié)構(gòu)效應(yīng):三維幾何碎片和分子性質(zhì)。
QSAR的步驟(圖3)如下:

制備用于QSAR實(shí)驗(yàn)的分子:獲得一組在類(lèi)似生物學(xué)測(cè)定中測(cè)試并顯示出廣泛作用的同屬配體。
訓(xùn)練集中描述符的選擇:識(shí)別并確定與化合物理化性質(zhì)相關(guān)的分子描述符。
計(jì)算訓(xùn)練集中描述符的值:將分子隨機(jī)分為兩組:訓(xùn)練集和測(cè)試集。使用訓(xùn)練集,識(shí)別并計(jì)算可以解釋描述符值與生物活性之間關(guān)系的相關(guān)系數(shù)。
內(nèi)部和外部驗(yàn)證評(píng)估:使用測(cè)試集分子,評(píng)估統(tǒng)計(jì)方法的穩(wěn)定性。
1.1.2.2 藥效團(tuán)建模
根據(jù)IUPAC的定義,藥效團(tuán)是“實(shí)現(xiàn)與給定生物靶標(biāo)的最佳超分子相互作用并觸發(fā)或預(yù)防其生物反應(yīng)所需的空間位阻和電子特性的集合”。藥效團(tuán)是對(duì)生物大分子識(shí)別配體所需結(jié)構(gòu)特性的抽象描述(表11)。
藥效團(tuán)建模工具如下。
表11 藥效團(tuán)建模工具
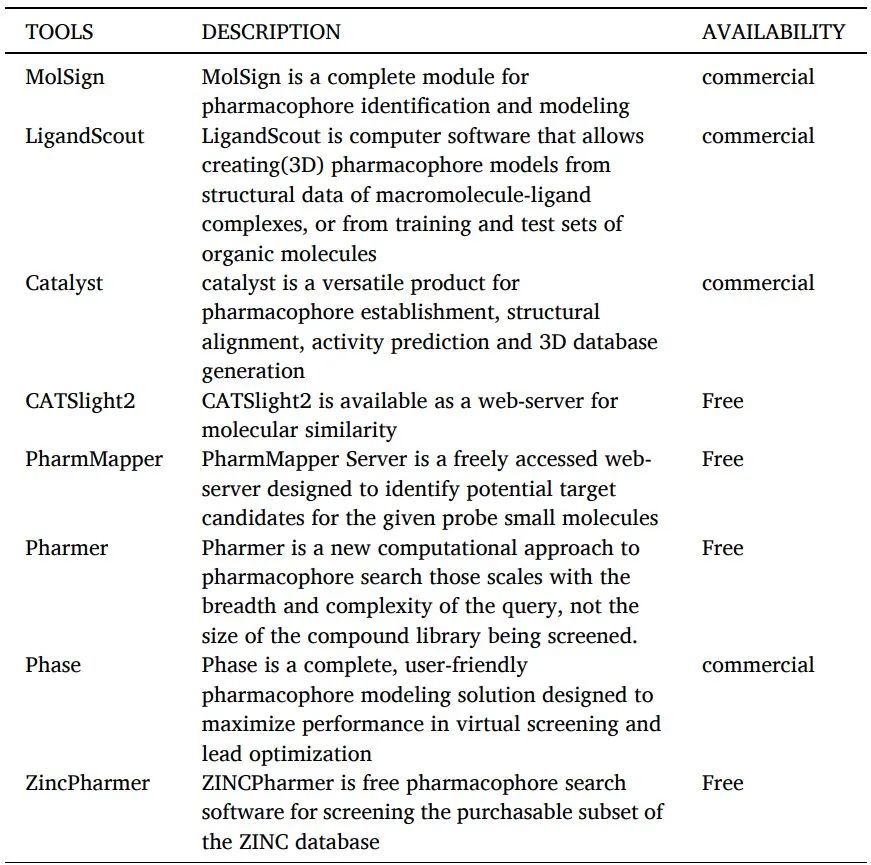
藥效團(tuán)建模中涉及的步驟(圖4)如下:

圖4 藥效團(tuán)建模中涉及的步驟
選擇一組訓(xùn)練配體:對(duì)于藥效團(tuán)模型開(kāi)發(fā),請(qǐng)選擇結(jié)構(gòu)多樣化的化合物組。分子列表應(yīng)包括活性和非活性化合物,因?yàn)樗幮F(tuán)模型必須能夠區(qū)分具有和沒(méi)有生物活性的分子。
構(gòu)象分析:為每種選定化合物創(chuàng)建一個(gè)低能量構(gòu)象列表,其中可能包括生物活性構(gòu)象。
分子疊加:疊加分子低能構(gòu)象的所有可能組合。可以擬合集合中所有分子中相似的官能團(tuán)(例如,苯基環(huán)或羧酸基團(tuán))。假定活性構(gòu)象是導(dǎo)致最佳擬合的構(gòu)象集合。
抽象:創(chuàng)建疊加分子的抽象表示。例如,疊加的苯基環(huán)在更概念的意義上可以稱(chēng)為“芳香環(huán)”藥效團(tuán)元素。
驗(yàn)證:藥效團(tuán)模型是一種假設(shè),用于解釋與同一生物靶標(biāo)結(jié)合的一組化合物的藥理作用。
1.2 藥物設(shè)計(jì)和藥物發(fā)現(xiàn)中的人工智能
人工智能是通過(guò)機(jī)器或計(jì)算機(jī)對(duì)人類(lèi)智能的模擬。它們通常通過(guò)訓(xùn)練大量預(yù)先訓(xùn)練的模型,分析相關(guān)性和模式的信息,然后使用這些模式進(jìn)行預(yù)測(cè)來(lái)工作。人工智能可以識(shí)別hit和先導(dǎo)化合物,更快地驗(yàn)證藥物靶標(biāo),并優(yōu)化藥物結(jié)構(gòu)設(shè)計(jì)。它還可以幫助靶向蛋白質(zhì)的 3D 結(jié)構(gòu)預(yù)測(cè)、蛋白質(zhì)-蛋白質(zhì)相互作用、藥物活性和從頭藥物設(shè)計(jì)(表13)。
表13 用于藥物發(fā)現(xiàn)的人工智能工具
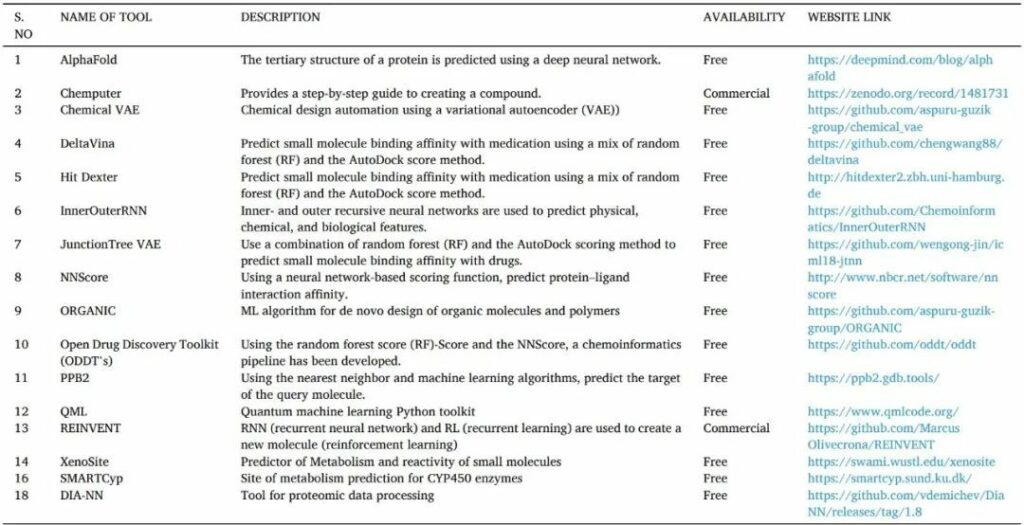
2 結(jié)論
上述CADD技術(shù)被廣泛認(rèn)為在所有情況下都遠(yuǎn)非完美和無(wú)所不能。為了有效地采用當(dāng)前的計(jì)算方法,必須克服相當(dāng)大的限制。人工智能、機(jī)器學(xué)習(xí)和深度學(xué)習(xí)方法可以與基本的CADD程序一起使用,以提供更準(zhǔn)確和準(zhǔn)確的結(jié)果。
本文詳細(xì)解釋了到目前為止計(jì)算工具和技術(shù)是如何應(yīng)用于藥物發(fā)現(xiàn)和開(kāi)發(fā)的。還描述了藥物發(fā)現(xiàn)和開(kāi)發(fā)過(guò)程中使用的當(dāng)前工具和軟件列表。
- END -
我們有個(gè)生物/化學(xué)計(jì)算云平臺(tái)
集成多種CAE/CFD應(yīng)用,大量任務(wù)多節(jié)點(diǎn)并行
應(yīng)對(duì)短時(shí)間爆發(fā)性需求,連網(wǎng)即用
跑任務(wù)快,原來(lái)幾個(gè)月甚至幾年,現(xiàn)在只需幾小時(shí)
5分鐘快速上手,拖拉點(diǎn)選可視化界面,無(wú)需代碼
支持高級(jí)用戶(hù)直接在云端創(chuàng)建集群
掃碼免費(fèi)試用,送200元體驗(yàn)金,入股不虧~

更多電子書(shū) 歡迎掃碼關(guān)注小F(ID:imfastone)獲取

你也許想了解具體的落地場(chǎng)景:
這樣跑COMSOL,是不是就可以發(fā)Nature了
Auto-Scale這支仙女棒如何大幅提升Virtuoso仿真效率?
1分鐘告訴你用MOE模擬200000個(gè)分子要花多少錢(qián)
LS-DYNA求解效率深度測(cè)評(píng) │ 六種規(guī)模,本地VS云端5種不同硬件配置
揭秘20000個(gè)VCS任務(wù)背后的“搬桌子”系列故事
155個(gè)GPU!多云場(chǎng)景下的Amber自由能計(jì)算
怎么把需要45天的突發(fā)性Fluent仿真計(jì)算縮短到4天之內(nèi)?
5000核大規(guī)模OPC上云,效率提升53倍
提速2920倍!用AutoDock Vina對(duì)接2800萬(wàn)個(gè)分子
從4天到1.75小時(shí),如何讓Bladed仿真效率提升55倍?
從30天到17小時(shí),如何讓HSPICE仿真效率提升42倍?
關(guān)于為應(yīng)用定義的云平臺(tái):
Uni-FEP on fastone|速石科技攜手深勢(shì)科技,助力創(chuàng)新藥物研發(fā)提速
【2021版】全球44家頂尖藥企AI輔助藥物研發(fā)行動(dòng)白皮書(shū)
創(chuàng)新藥研發(fā)九死一生,CADD/AIDD是答案嗎?
這一屆科研計(jì)算人趕DDL紅寶書(shū):學(xué)生篇
AI太笨了……暫時(shí)
幫助CXO解惑上云成本的迷思,看這篇就夠了
國(guó)內(nèi)超算發(fā)展近40年,終于遇到了一個(gè)像樣的對(duì)手
花費(fèi)4小時(shí)5500美元,速石科技躋身全球超算TOP500
【大白話(huà)】帶你一次搞懂速石科技三大產(chǎn)品:FCC、FCC-E、FCP